Le parc de Grignon abrite de nombreux oiseaux caractéristiques de l’Ile-de-France. Cetta avifaune est régulièrement étudiée. Elle fait toujours l’objet de relevés par des étudiants avec l’appui du CORIF / LPO Ile-de-France (voir la liste sur le site des naturalistes d’Ile-de-France). Une équipe de chercheurs du centre d’écologie et des sciences de la conservation (CESCO) au MNHN (Philippe Clergeau, Frédéric Jiguet) mène actuellement depuis 2011 une étude sur la reproduction des passereaux cavernicoles en fonction d’un gradient d’urbanisation.
Table des matières
Guide sur les oiseaux du parc de Grignon
Une étude importante a été publiée en 1997 par Frédéric Archaux (alors étudiant et actuellement chercheur à l’Irstea) : “Les oiseaux du parc de Grignon et de la Région parisienne”, préface de Jean Dorst de l’Académie des sciences, avec les soutiens de la Fondation Nicolas Hulot, de la Fondation La Ferthé, de l’Ina P-G et de son amicale des anciens. Ce travail a repris et complété l’étude réalisée en 1985. L’ouvrage a fait l’objet d’un article dans le numéro 20 de la revue “Ma planète” en mai-juin 1998.
On trouvera ci-après des extraits de cet ouvrage : introduction, liste des espèces, évolution de 1974 à 1996, bibliographie.
Introduction
Les observations récoltées proviennent d”un rapport sur l’état de la faune du parc en 1973/1974, et de données recueillies de mi-septembre 1995 à fin juin 1996 (avec une coupure du 25 mars au 25 avril). Un guide sur les oiseaux de Grignon réalisé en 1985 par deux étudiants de l’Ina P-G, a également apporté quelques données intermédiaires (comme la présence du Chevalier culblanc), mais s’appuie essentiellement sur les observations du rapport de 1973/1974.
La collecte des données et les objectifs d`observation n’ont pas été les même dans les deux cas. L’étude de 1974 est principalement quantitative, avec un protocole particulier. Plusieurs étudiants de première année ont été chargés de suivre à chaque sortie le même itinéraire, pour calculer des indices d’abondance, selon la qualité de l’observation (mâle chanteur, femelle cantonnée).
La quasi-totalité des observations de 1995/1996 proviennent d’un seul observateur. Cinquante deux sorties de 3 à 7 heures ont été effectuées surtout dans la partie sud du parc, privilégiant les milieux découverts, les lisières sur le milieu forestier. L’effort a surtout été porté sur le dénombrement des espèces, en négligeant un peu le comptage des espèces nicheuses.
Les observations (essentiellement celles de 1995/1996, par manque de données sur les années antérieures) ont été reportées pour chaque espèce : chaque carré représente à la fois la fréquence d’observation (rare, courant), et l’effectif (peu, beaucoup). Ce système permet de se faire une bonne idée de l’effectif total par espèce, sachant le statut de l’espèce dans le parc et le calendrier d’observation (dont le trait plus ou moins large témoigne de la rareté des observations à un mois donné). ll reste cependant une part de subjectivité d`autant plus importante que l’espèce est commune et largement répartie dans le parc.
A partir de ces données ont été dégagés les effectifs maximaux, les dates extrêmes d’observation (pour les espèces migratrices), le nombre de couples (ou plus généralement son estimation), à chaque fois que cela a été possible.
Le commentaire qui suit évoque l’évolution de la population pour chaque espèce depuis 1974, et s’attache à en analyser les causes.
Liste des espèces
Voici la liste des 104 espèces décrites dans l’ouvrage (cliquer sur le nom français pour voir la présentation illustrée par une planche originale en couleur) :
Nom français |
Nom latin |
Présence en 1996 |
|---|---|---|
Prunella modularis |
sédentaire |
|
Alauda arvensis |
sédentaire, hivernante |
|
Lullula arborea |
nicheuse disparue |
|
Accipiter gentilis |
acidentel (?) |
|
Scolopax rusticola |
hivernante |
|
Gallinago gallinago |
hivernante |
|
Motacilla cinerea |
hivernante |
|
Motacilla alba |
nicheuse, hivernante |
|
Motacilla flava |
occasionnelle |
|
Pyrrhula pyrrhula |
sédentaire (?) |
|
Emberiza schoeniclus |
occasionnel (?) |
|
Emberiza citrinella |
hivernant occasionnel (?) |
|
Miliara calandra |
estivant |
|
Circus cyaneus |
hivernant |
|
Buteo buteo |
hivernante, nicheuse possible |
|
Coturnix coturnix |
estivante |
|
Anas platyrhynchos |
hivernant, nicheur |
|
Anas clypeata |
nicheur disparu, occasionnel (?) |
|
Carduelis carduelis |
sédentaire, migrateur partiel |
|
Tringa ochropus |
hivernant |
|
Corvus monedula |
hivernant, nicheur disparu |
|
Athene noctua |
nicheuse disparue (?) |
|
Tyto alba |
sédentaire |
|
Strix aluco |
sédentaire |
|
Corvus frugileus |
hivernant, nicheur disparu |
|
Corvus corone |
sédentaire, migratrice partielle |
|
Cuculus canorus |
estivant |
|
Numenius arquata |
accidentel |
|
Accipiter nisus |
hivernant, nicheur possible |
|
Sturnus vulgaris |
sédentaire, hivernant |
|
Phasianus colchicus |
sédentaire |
|
Falco tinnunculus |
sédentaire |
|
Sylvia atricapilla |
estivante |
|
Sylvia borin |
estivante |
|
Sylvia communis |
estivante |
|
Garrulus glandurius |
sédentaire |
|
Phalacrocorax carbo |
occasionnel |
|
tachybaptus ruficolis |
hivernant |
|
Certia brachydactyla |
sédentaire |
|
Turdus viscivorus |
sédentaire |
|
Turdus pilaris |
hivernante |
|
Turdus iliacus |
hivernante |
|
Turdus philomenos |
sédentaire |
|
Grus grus |
accidentelle |
|
Ardea cineara |
hivernant |
|
Asio otus |
occasionnel, hivernant (?) |
|
Hippolais polyglotta |
occasionnelle (?) |
|
Delichon urbica |
estivante |
|
hirondelle rustique (de cheminée) |
Hirunda rustica |
estivante |
Carduelis cannabina |
hivernante, nicheuse (?) |
|
Locustella naevia |
occasionnelle (?) |
|
Oriolus oriolus |
nicheur occasionnel (?) |
|
Alcedo atthis |
occasionnel |
|
Apus apus |
estivant |
|
Turdus merula |
sédentaire |
|
Aegithalos caudatus |
sédentaire |
|
Parus caeruleus |
sédentaire |
|
Parus major |
sédentaire |
|
Parus cristatus |
sédentaire |
|
Parus palustris |
sédentaire |
|
Passer domesticus |
sédentaire |
|
Passer montanus |
nicheur disparu (?) |
|
Larus ridibundus |
hivernante |
|
Anser anser |
occasionnelle |
|
Perdix perdix |
sédentaire |
|
Alectoris rufa |
sédentaire (?) |
|
Dendrocopos major |
sédentaire |
|
Dendrocopos minor |
hivernant |
|
Dryocopus martius |
sédentaire |
|
pic vert (Pivert) |
Picus viridis |
sédentaire |
Pica pica |
sédentaire, non nicheuse (?) |
|
Lanius excubitor |
accidentelle |
|
Columba livia |
sédentaire, introduit |
|
Columba oenas |
sédentaire |
|
Columba palumbus |
sédentaire, hivernant |
|
Fringilla coelebs |
sédentaire, hivernant |
|
Fringilla montrifringilla |
hivernant occasionel |
|
Anthus trivialis |
nicheur disparu (?) |
|
Anthus pratensis |
hivernant |
|
Anthus spinoletta |
hivernant (?) |
|
Pluvialis apricaria |
hivernant |
|
Phylloscopus trochilus |
estivant (?) |
|
Phylloscopus sibilatrix |
estivant (?) |
|
Phylloscopus collybita |
migrateur partiel |
|
Gallinula chloropus |
hivernant, nicheur |
|
Rallus aquaticus |
hivernant, nicheur possible |
|
Regulus regulus |
migrateur partiel |
|
regulus ignicapillus |
hivernant |
|
Luscinia megarhynchos |
nicheur disparu |
|
Erithacus rubecula |
sédentaire |
|
Phoenicurus phoenicurus |
nicheur disparu (?) |
|
Phoenicurus ochruros |
migrateur partiel |
|
Anas crecca |
occasionnelle |
|
Serinus serinus |
sédentaire |
|
Sitta europea |
sédentaire |
|
Saxicola rubetra |
occasionnel, nicheur disparu |
|
Saxicola torquata |
nicheur occasionnel |
|
Carduelis spinus |
hivernant occasionnel |
|
Streptopelia decaocto |
sédentaire |
|
Streptopelia turtur |
estivante |
|
Oenanthe oenanthe |
occasionnel |
|
Troglodytes troglodytes |
sédentaire |
|
Vanellus vanellus |
hivernant |
|
Carduelis chloris |
sédentaire |
Evolution de 1974 à 1996
En un peu plus de vingt ans, la plupart des espèces du parc ont vu leur statut changer de façon significative.
Nombre d’espèces |
1973/1974 |
1995/1996 |
Différence |
|---|---|---|---|
Recensées |
82 |
89 |
+7 |
Nicheuses (+ probables) |
64 |
55 |
-9 |
Hivernantes |
l3 |
19 |
+6 |
Occasionnelles/accidentelles |
5 |
15 |
+10 |
C’est à travers les espèces nicheuses ou hivernantes, bioindicateurs fiables, que l’on peut caractériser la richesse du milieu.
Espèces nicheuses
Elles comprennent à la fois des espèces sédentaires, ainsi que les estivantes qui ne passent que la belle saison dans le parc. Le tableau suivant récapitule les changements constatés.
Disparues |
En régression |
En progression |
Apparues |
|---|---|---|---|
Alouette lulu 1 |
Bouvreuil 2 |
Canard colvert 8 |
Pic noir 7 |
Berg. ruisseaux 1, 2 |
Linotte 2, 3 |
Hirondelle de fenêtre 8, 9 |
Caille ?, 9 |
Bruant jaune 2, 3 |
Bruant proyer 3 |
Etourneau 8 |
Epervier 7, 7 |
Canard souchet ?, 1 |
Fauvette grisette 2 |
Pic épeichette 7, 8 |
Hypolaïs polyglotte ?, 9 |
Corbeau freux 4 |
Fauvette des jardins 2 |
Pigeon ramier 7 |
Râle d’eau ?, 8 |
Chouette chevêche 1, 2, 3 |
Pouillot siffleur 6 |
Poule d’eau 8 |
|
Loriot 5 |
Geai 5 |
Serin cini 7 |
|
Moineau friquet 3 |
Perdrix grise 3 |
||
Choucas 4 |
Pie 4 |
||
Pie-grièche grise 1 |
Coucou ?, 5 |
||
Pipit des arbres 2 |
Tarier pâtre 2 |
||
Rossignol 2 |
Tourterelle des bois 2 |
||
Rouge-queue à front blanc 1, 2 |
Chardonneret 2 |
||
Tarier des prés 1, 2 |
Espèces disparues et en déclin
Selon les espèces, les causes de la raréfaction sont différentes, mais l’on peut distinguer principalement les raisons suivantes :
- (l) L’espèce connaît un déclin régional, sinon national.
- (2) Les changements de milieux sont la principale cause de disparition des espèces dans le parc. Le parc s’est notamment démuni d’un milieu arbustif, buissonneux (Défonce, Verger) et de prairies (près du parc à moutons).
- (3) L’intensification de l’agriculture (récoltes précoces et insecticides) a privé les espèces campagnardes d’un milieu favorable pour nicher.
- (4) Malgré la protection dont elles jouissent, certaines espèces ont fait l’objet de destructions systématiques ou d’interdiction d’accès à leur site de nidification.
- (5) D’autres causes plus diffuses (dérangement, endiguement du Rû) peuvent expliquer certaines régressions.
- (6) La pression d’observation a été malgré tout trop faible en 1995/l996 pour cerner avec toute l’exactitude souhaitée le statut de chaque espèce (notamment concernant celles en progression ou en régression).
Espèces en progression
Il faut avant tout remarquer qu’à l’exception du Pic noir, les autres implantations ne sont que supposées, et donc très fragiles (de l’ordre de 1 à 2 couples). Les causes peuvent être regroupées en trois catégories :
- (7) L’espèce est en expansion générale (souvent suite à sa protection en 1976).
- (8) Le milieu est devenu plus accueillant, ce qui est le cas du Rû moins pollué qu’en 1974, ou même des champs qui peuvent procurer une nourriture “artificielle” (comme le maïs l’hiver pour le Pigeon ramier).
- (9) L’espèce fluctue annuellement, ce qui rend son observation aléatoire d’une année sur l’autre.
Conclusion sur les espèces nicheuses
Dans le rapport de 1974, il est noté qu’autour des années 1970, le Râle d’eau et le Canard souchet nichaient encore sur le Rû, soit deux espèces disparues en quatre ans. ll est intéressant de remarquer qu’en l’espace de vingt ans, 14 espèces ont disparu, respectant cet ordre de grandeur de l’ordre de 3 à 4 espèces tous les 5 ans.
Globalement, on assiste à un net appauvrissement de l’avifaune nicheuse, puisque 28 espèces sont au moins en régression, contre 12 seulement en progression. Et il est à craindre la disparition prochaine du Tarier pâtre, du Chardonneret et de la Linotte mélodieuse. La restauration d`un milieu un peu arbustif, sinon buissonneux, d’une légère extension des prairies bordant le Rû (évitant en même temps une pollution agricole par ruissellement), permettrait de maintenir ces espèces menacées à l’échelle du parc, et vraisemblablement de favoriser le retour de quelques autres.
Espèces hivernantes
Le tableau suivant reprend certaines espèces du tableau précédent, nicheuses probables seulement en l996, mais qui ont hiverné l’hiver 1995/1996. Ne sont pas prises en compte les espèces sédentaires, sauf le Pigeon ramier dont la population hivernale est beaucoup plus importante que l’effectif nicheur (hivernage de nombreux migrateurs nordiques).
Disparues |
En régression |
En progression |
Apparues |
|---|---|---|---|
Aucune |
Bécasse |
Busard St Martin 3 |
Chevalier culblanc 1 |
Hibou moyen-duc |
Mouette rieuse 1,3 |
Epervier 2, 3 |
|
Héron cendré 1,3 |
Grèbe castagneux 2 |
||
Bécassine 1 |
Pipit spioncelle 1, 2 |
||
Sarcelle 2 |
Pipit farlouse 1, 2 |
||
Pigeon ramier 3 |
Râle d’eau 1 |
||
Pic épeichette 2 |
Pluvier doré 2 |
||
Vanneau huppé 2 |
Espèces en régression
Toutes les espèces notées comme hivernant dans le parc en 1973/1974 ont été revues en 1995/1996, les biotopes qui ont disparu entre-temps ne représentant pas un milieu particulier d°hivernage.
La discrétion de la Bécasse et du Hibou moyen-duc rend aléatoire leur suivi dans le parc, et ils peuvent ainsi facilement passer inaperçus.
Espèces en progression
(1) Ce sont avant tout des oiseaux d’eau (8 espèces sur 14), qui ont profité de l’amélioration de la qualité des eaux (nourriture plus abondante).
(2) D’autre part, la recherche et le suivi de ces espèces ont été probablement plus intensifs en 1995/1996, ce qui a permis de noter quelques espèces parfois difficiles à identifier.
(3) Enfin, certaines espèces sont depuis leur protection en large expansion.
Conclusion sur les espèces hivernantes
Les modifications du parc en vingt ans ont finalement peu affecté la physionomie hivernale du parc. Au contraire, la meilleure qualité des eaux du Rû se voit bien confirmée par le retour de plusieurs espèces. Le parc est en hiver une zone refuge notable, assez calme et avec une faible pression de chasse sur l’avifaune.
Espèces accidentelles
La présence d’espèces migratrices reflète plus l’effort de recherche que la qualité d’accueil du parc, simple halte migratoire, quand il n’est pas simplement situé sur la voie de passage. Cela explique le nombre plus important d’espèces trouvées en 1995/1996, où ces espèces d’un jour ont été particulièrement visées.
Ces observations concernent soit des migrateurs (Oie, Grue, Cormoran, Traquet motteux, Tarier des prés), soit des individus erratiques (Martin-pêcheur). Les coups de froid (rares en l995/1990) peuvent aussi apporter quelques espèces nordiques (Tarin, Bruant des roseaux).
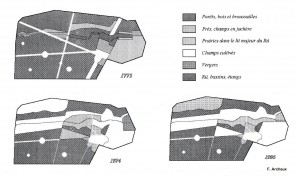
Evolution de l’utilisation de l’espace et évolution de l’avifaune
L’évolution récente témoigne d’un déboisement régulier du parc, au profit des champs cultivés. Ne sont restées en prairies que les zones basses, marquées par une importante hydromorphie. Certaines parcelles, naturellement peu propices à un usage agronomique ont été souvent remaniées, telle la Défonce : débroussaillage, tentative de reboisement, mise en culture (1974) et enfin mise en pâture depuis deux ans.
Si le déboisement n’a pas nécessairement un impact négatif sur l’avifaune (puisqu’il crée de nouveau milieux), il semble que le morcellement des différents milieux (notamment des prairies en bord du Rû) ait un impact négatif.
Il est alors probable que le déboisement du parc se soit d’abord accompagné de l’augmentation du nombre d’espèces fréquentant les milieux arbustifs ou bocagers ainsi créés, jusqu’à un stade optimal, probablement avant la seconde guerre mondiale. Mais l’intensification des cultures à l’intérieur de l’enceinte, s’accompagnant d’une dégradation globale du milieu (dont la pollution du Rû), a dû progressivement signer la disparition de plusieurs espèces sensibles (Alouette lulu, Pie-grièche grise, Tarier des prés).
Ainsi la richesse acquise en diversifiant les biotopes risque à terme d’être à nouveau perdue.
Conclusion sur l’évolution de l’espace et évolution de l’avifaune
Le parc est toujours une zone refuge, plus particulièrement en hiver. Il accueille ainsi l’avifaune typique de l’lle-de-France, avec quelques particularités telles le Râle d’eau ou le Pic noir.
A la fois zone récréative et plus accessoirement de chasse, ce parc proche de Versailles constitue un endroit encore préservé de loisirs trop destructeurs (V.T.T.).
Cependant des menaces pèsent sur ce parc. Le manque de gestion forestière ferme le milieu, en même temps qu’il réduit sa diversité en terme d’espèces animales comme végétales.
De même, on ne peut que s’interroger sur l’existence d’une décharge au beau milieu de la Côte aux Buis, alors même que cette hêtraie-buisaie constitue la grande originalité forestière du parc.
Enfin, la fréquence des épandages de lisier et des boues d’épuration sur les parcelles des Divisions et de la Défonce a de quoi laisser perplexe quant à la qualité future des eaux et des sols (et donc indirectement sur la biodiversité du parc).
Le parc réservera très certainement d’autres surprises a l’observateur attentif (le Canard pilet et le Bécasseau variable auraient été vus durant le coup de froid de janvier 1997 dans le parc). Et le statut de nombreuses espèces reste à préciser.
Références bibliographiques
- De Albuquerque C., Chanceaulme A., Latour O., Thibierge J., Arbres et arbustes du parc de Grignon, 1986, non édité
- Jonsson L., Les oiseaux d’Europe, d »Afrique du nord et du Moyen-Orient, 1994, Nathan, Paris
- Latour O., De Albuquerque C., Les oiseaux du parc de Grignon, 1985, non édité
- Pinet J .M., Centre d’étude et de recherche en écologie appliquée, CEREA, Etude d’environnement, Le parc de Grignon, faune, menaces et perspectives d’avenir, 1974, non édité
- Perrins C., Cuisin M., Les oiseaux d’Europe, 1987, Delachaux et Niestlé, Neuchâtel, Paris
- Siblet J .P., Les oiseaux du massif de Fontainebleau et des environs, 1988, Chabaud – Le Chevalier, Paris
- Steinbach G., Les oiseaux d’Europe tomes 1 et 2, 1987, Solar, Paris